С развитием в медицине цифровых технологий, таких как 3D-печать органов и тканей человека, искусственный интеллект (ИИ), виртуальная и дополненная реальности (VR/AR) и нанотехнологии, фантастические сценарии будущего стали воплощаться на наших глазах. В ближайшее время одни роботы будут оперировать наравне с людьми, а другие, размером с пекарские дрожжи, станут лечить сложные онкологические заболевания. Мы сделали подборку новейших медицинских технологий, которые уже совершили прорыв в индустрии в последние несколько лет и еще заявят о себе в скором будущем.
1. Технология редактирования генома CRISPR-Cas9
Редактирование генов — перспективное направление молекулярной биологии. А одним из самых востребованных инструментов редактирования считается система CRISPR-Cas9. В 2020 году ученые Эмманюэль Шарпантье и Дженнифер Дудна получили за ее разработку Нобелевскую премию.
Система CRISPR-Cas — это часть адаптивного иммунитета бактерий и архей. Она состоит из двух блоков — CRISPR и Cas — и защищает своего хозяина от бактериальных вирусов на молекулярном уровне.

CRISPR — это участки на ДНК бактерий, внутрь которых встраивается информация о вирусах, которые когда-то нападали на клетку хозяина. Блок с уникальной информацией о конкретном вирусе называется спейсером. Информация в спейсерах позволяет CRISPR отслеживать повторное проникновение того же вируса.
Второй элемент этого молекулярного механизма — белок Cas. Он действует как молекулярные ножницы и разрезает на фрагменты чужеродные ДНК, которые проникают в клетку бактерии.
При повторном заражении бактерии CRISPR с помощью спейсера находят информацию о знакомой чужеродной ДНК и направляют белок Cas на точечное устранение патогена.
Есть целый ряд систем CRISPR-Cas, но чаще всего в лабораториях прибегают к наиболее прицельной технологии генетических ножниц — CRISPR-Cas9. Она оказалась быстрее, дешевле и точнее других методов редактирования. Система состоит из CRISPR, белка Cas9 и направляющей РНК (sgRNA). sgRNA указывает Cas9 на цель уничтожения. Белок Cas9 разрезает этот участок, затем запускается система восстановления клетки. А дальше биотехнологи внедряют нужную последовательность ДНК в целевой участок.
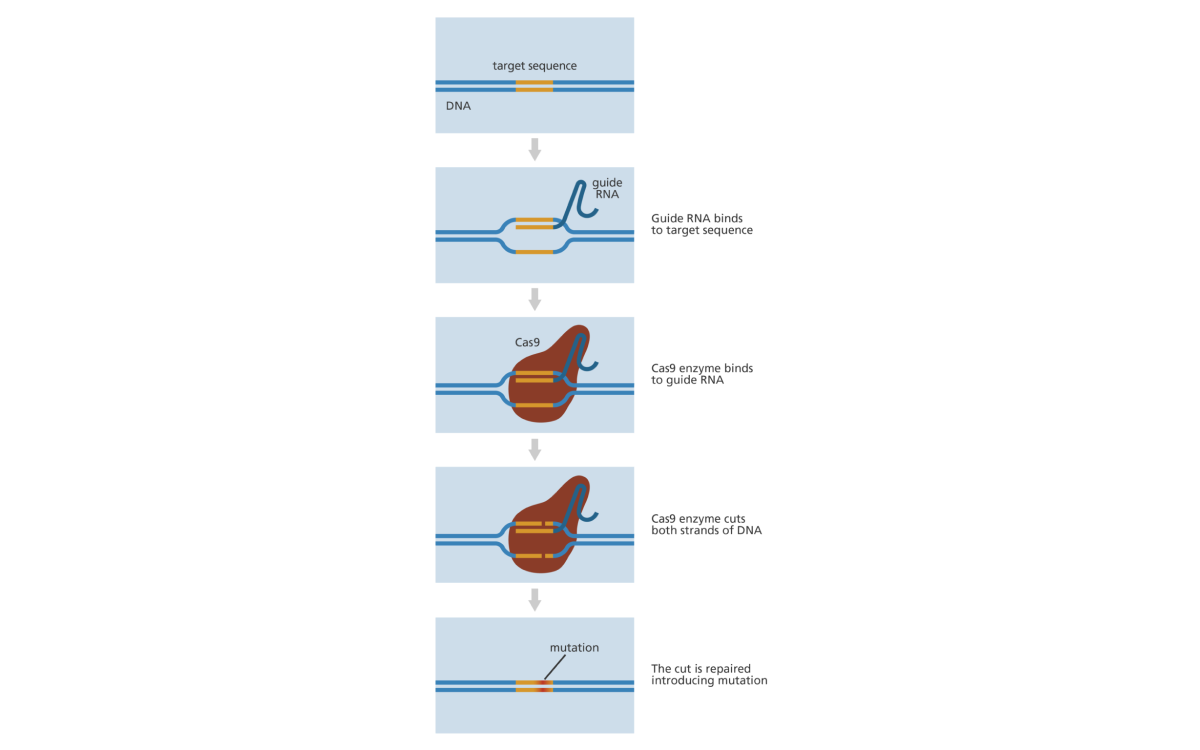
Дудна и Шарпантье выяснили, что такие системы работают не только в клетках бактерий. Их можно пересаживать в клетки высших организмов с помощью молекул-переносчиков. Молекула, внутрь которой помещена система CRISPR-Cas9, внедряется в клетки и позволяет ученым использовать молекулярные ножницы в своих целях.
С помощью CRISPR-Cas9 становится проще изучать и лечить моногенные заболевания, такие как гемофилия, муковисцидоз, болезнь Альцгеймера (одна из форм) и другие.
Так, в 2023 году впервые в мире одобрили терапию на основе CRISPR-Cas9. В Великобритании для лечения серповидноклеточной анемии и бета-талассемии будут использовать препарат с торговым названием Casgevy. При этих болезнях нарушается работа гемоглобина. Терапия проходит в три этапа. Пациент сдает кровь, клетки которой подвергаются генной модификации. Ученые «выключают» ген BCL11A в клетках крови. Дело в том, что во время развития плода в его организме вырабатывается особый — фетальный — тип гемоглобина. Ген BCL11A подавляет выработку фетального гемоглобина после рождения человека. После генной модификации выработка фетального гемоглобина возобновляется, и он постепенно заменяет гемоглобин взрослого человека. Затем отредактированные клетки крови вводят пациенту обратно. Весь процесс занимает несколько месяцев, а терапевтический эффект, как считают ученые, распространяется на долгие годы.
2. мРНК-вакцины
В 2023 году лауреатами Нобелевской премии по физиологии и медицине стали биохимики Каталин Карико и Дрю Вайсман. Свою награду они получили за разработку технологии, которая позволила быстро создать эффективные мРНК-вакцины против COVID-19. Так, на 63-й день разработки будущая прививка уже проходила первое клиническое испытание.

Сегодня мРНК-вакцины применяются для борьбы с множеством болезней. Принцип работы вакцины такой: воссоздавая фрагменты мРНК вируса, она учит иммунные клетки человека создавать копии шиповидного белка (S-белок, или spike protein) патогена. С помощью S-белков патоген и проникает в клетки организма. Если носитель вакцины сталкивается с настоящей угрозой, срабатывает его иммунологическая память, и клетки быстро распознают опасность, не давая вирусу времени на размножение.
Так, в 2023 году группа ученых из Новой Зеландии и Австралии под руководством профессора Гэвина Пейнтера разработала вакцину на основе мРНК для защиты от малярии. А в 2024 году исследователи из биотехнологической компании Moderna (США) опубликовали результаты по новой мРНК-вакцине против цитомегаловируса. Препарат пока находится на финальном этапе клинических испытаний. Прививка показывает 50-процентную эффективность в многочисленных исследованиях. Руководитель проекта Салли Пермар предполагает, что дальнейшие исследования могут привести к регистрации вакцины в ближайшие годы.
Активно ведутся и разработки противораковых вакцин. Это касается, например, достаточно редкой и агрессивной формы онкологического заболевания — рака поджелудочной железы. Так, пятилетняя выживаемость при этом раке, согласно исследованиям американского Национального института онкологии (период с 2013 по 2019 год), составляет всего 12,5%.
Вакцина на платформе мРНК может предотвратить возвращение новообразований после операций. К таким выводам пришли авторы статьи, опубликованной в журнале Nature. Исследование проводилось под руководством профессора Винода Балачандрана из Мемориального онкологического центра им. Слоуна-Кеттеринга в Нью-Йорке.
Хотя в экспериментальную группу входили всего 16 пациентов, это первый пример успешной разработки вакцины против рака поджелудочной железы. После полугода обследований половина участников испытаний вышла в ремиссию.
3. «Умные» таблетки
Разработка «умных» таблеток считается одним из перспективных направлений биоразлагаемой электроники. Идея состоит в том, что пациент глотает устройство размером с таблетку. Она, как правило, состоит из полимерных электродов, которые заменяют пилюле двигатель и заставляют ее двигаться. Устройство помещают в биоразлагаемую капсулу. Оказавшись в ЖКТ, таблетка анализирует состояние тканей, стимулирует мышцы током или доставляет лекарства. Выполнив свою работу, она выходит из организма естественным путем.
Чаще всего «умные» таблетки применяют в капсульной эндоскопии. Пациент проглатывает устройство с встроенной видеокамерой, после чего капсула начинает фотографировать ткани ЖКТ. В результате исчезает необходимость в использовании трубки-эндоскопа. Впрочем, специалисты настаивают на том, что такая система не заменяет эндоскопию: она не может забирать материалы на биопсию, поэтому диагностическая ценность у нее ниже, чем у традиционных процедур.
Группа биотехнологов из Стэнфорда и Университета штата Огайо также создала устройство, способное внедряться в труднодоступные зоны тела. Робот выглядит как дождевой червь: он сокращает отдельные части своего механизма, раздвигая другие по принципу гармошки. Гусеничная походка позволяет ему преодолевать сопротивление жидкостей организма и прочно закрепляться в исследуемой области. Авторы изобретения считают, что их разработку можно использовать в эндоскопии, биопсии, для адресной доставки лекарств.
4. 3D-печать органов и тканей
Одной из наиболее перспективных технологий создания искусственных органов считается на сегодня 3D-печать. Первая успешная пересадка искусственного органа на основе клеток пациента произошла в 2022 году. Американская компания 3DBio Therapeutics напечатала ухо для 20-летней девушки.
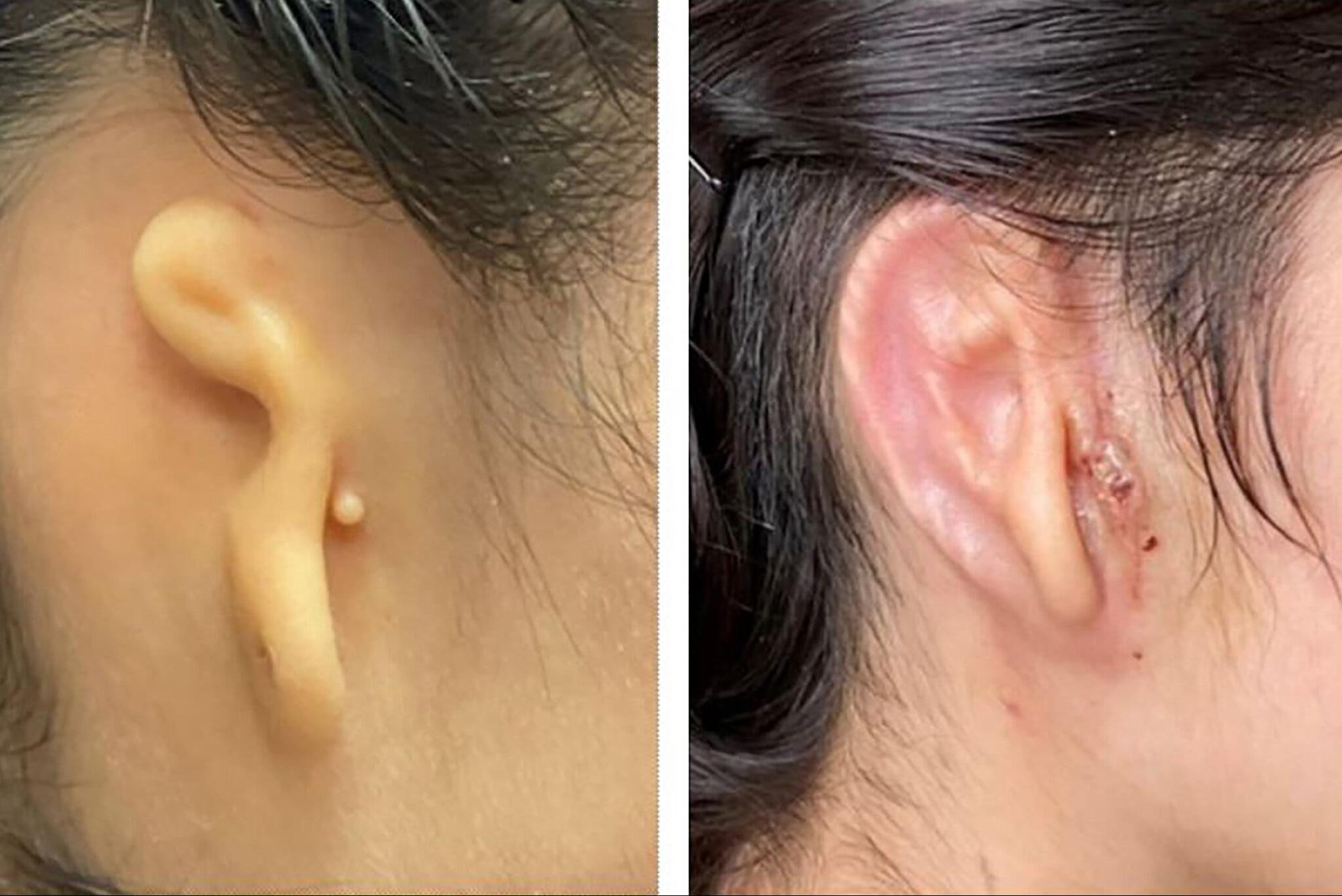
Современные 3D-биопринтеры создают органы в несколько этапов. Сперва на компьютере с помощью снимков МРТ и КТ строится полная трехмерная модель макро- и микроструктуры органа. Затем отбираются стволовые клетки пациента, которые в будущем оформятся в клетки мышц, кожи, уретры и т.д. Ученые заселяют клетками картридж принтера — там они выдерживаются в гидрогеле. В процессе печати клетки-биочернила слой за слоем переносятся с картриджа на подложку и соединяются под действием сил поверхностного натяжения в заданную компьютером форму.
Полученная «запчасть» помещается в биосреду, там она «дозревает» в течение нескольких недель. На последнем этапе орган пересаживают и следят за тем, как он приживается в теле.
Кроме аддитивных (послойных) есть принтеры, использующие в качестве чернил коллаген. Такие принтеры печатают недостающие ткани непосредственно на ране.
Новый тип такого принтера разработали в 2023 году биоинженеры из Университета Нового Южного Уэльса в Сиднее. Австралийские ученые представили прототип, печатающий клетки сразу на органах желудочно-кишечного тракта. Аппарат проникает в организм как эндоскоп и заменяет поврежденные клетки новыми. Принтер доставляет их напрямую в различные сегменты ЖКТ. Такой малоинвазивный способ доставки клеток позволяет избежать операции и, следовательно, послеоперационных осложнений. Устройство протестировали на смоделированной толстой кишке. На следующем этапе принтер будет тестироваться на животных.
5. Терапия CAR-T
На протяжении долгих лет традиционными методами лечения рака были хирургическое вмешательство, химио- и лучевая терапия. Они по-прежнему остаются основой лечения, но при этом активно внедряются новые методы иммунотерапии, например терапия CAR-T.
За распознавание чужеродной ДНК в организме отвечают Т-клетки иммунитета, которые находят патоген с помощью химерных антигенных рецепторов (CAR). Терапия CAR-T позволяет перепрограммировать эти рецепторы Т-клеток так, чтобы они распознавали не только чужеродную ДНК, но еще и опухолевые клетки собственного организма и уничтожали их.
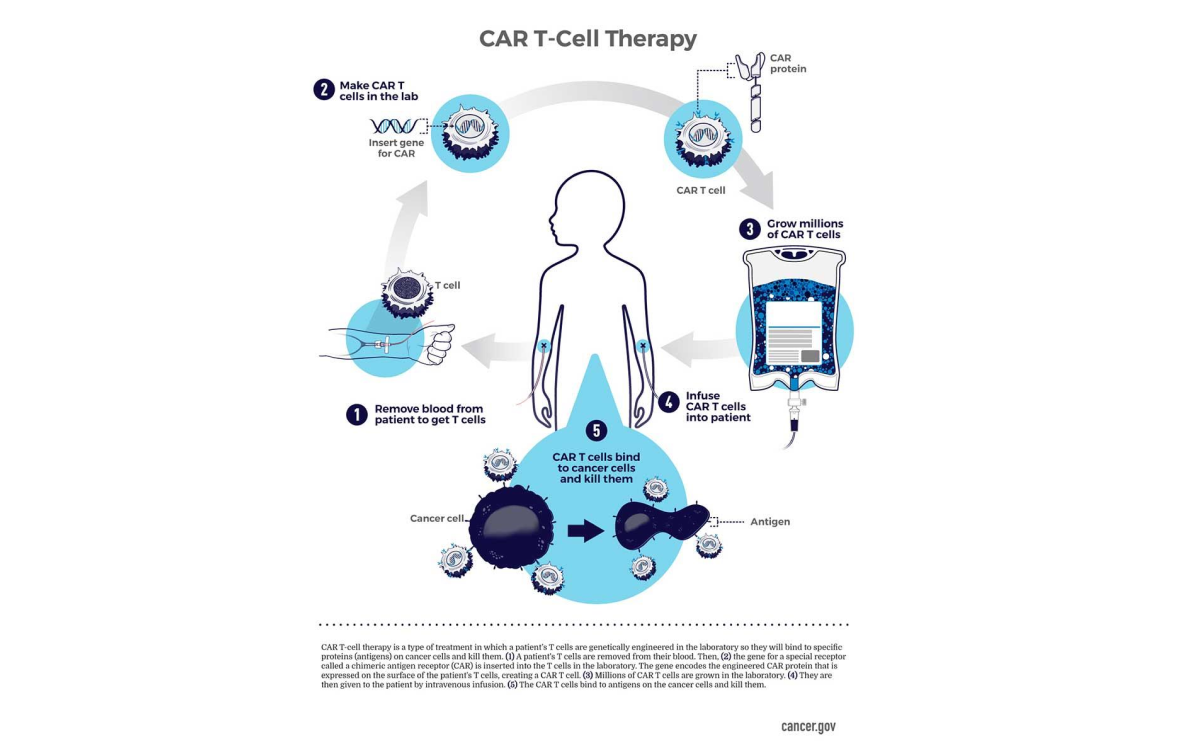
С 2017 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило шесть методов терапии CAR-Т-клетками — для лечения агрессивных форм лимфомы, лейкемии и множественной миеломы.
Технологию также применили для борьбы со старением, правда, пока только у мышей. В начале 2024 года вышло исследование, в котором ученые используют CAR-T для уничтожения стареющих клеток. Группа американских биологов под руководством Корины Амор из лаборатории «Колд-Спринг-Харбор» возлагает большие надежды на CAR-T в борьбе с возрастной метаболической дисфункцией — стареющими клетками, которые еще не погибли. По мере старения иммунитет хуже справляется с ликвидацией таких клеток. Из-за этого они накапливаются, увеличивая вероятность хронического воспаления. Исследование проходило на 20-месячных (пожилых) и трехмесячных (молодых) мышах. После введения CAR-Т-клеток у грызунов постарше улучшился метаболизм: снизился уровень глюкозы в крови натощак и инсулинорезистентность. Они стали активнее и выносливее. Спустя год после введения Т-клеток молодым мышам у них значительно снизилась масса тела и сократилось количество стареющих клеток в поджелудочной железе, печени и жировой ткани.
6. Роботы-хирурги
Роботизированная хирургия начала развиваться в 1980-х годах. Считается, что первопроходцем в ней был ассистент хирургов робот Arthrobot. Первая операция с его помощью прошла 12 марта 1984 года в ванкуверской больнице UBC. В течение года местные хирурги провели более 60 операций с участием Arthrobot. Усовершенствованные модели машины до сих пор ассистируют хирургам-ортопедам.
Сейчас стремительно растет рынок ИИ в области медицины. По прогнозам компании GlobalData, количество операций с использованием роботов будет увеличиваться в период до 2030 года на 10,5% каждый год. К этому моменту около 87% хирургических операций будет выполнять робот.
Одним из первых автоматических аппаратов в хирургии была система da Vinci от Intuitive Surgical. Прототип da Vinci был разработан в США в конце 1980-х годов. А сегодня эта платформа используется по всему миру.
Другой популярный инструмент роботизированной хирургии — аппарат The CyberKnife от компании Accuray Incorporated. Он используется для лучевой терапии рака. Система включает роботизированную руку с линейным ускорителем, который облучает ткани под разными углами. Технология VR корректирует подачу излучения. Аппарат не повреждает (или минимально повреждает) окружающие здоровые ткани и позволяет за меньшее количество сеансов, чем при традиционной лучевой терапии, добиться эффекта. Систему чаще всего применяют для облучения опухолей в труднодоступных областях, например в мозге и позвоночнике.
Прорывом роботизированной хирургии можно считать успешную операцию робота-хирурга Smart Tissue Autonomous Robot, разработанного в Университете Джонса Хопкинса. В 2022 году он выполнил операцию на кишечнике свиньи, действуя полностью автономно.
7. Микро- и нанороботы
Перспективными инструментами диагностики и терапии называются в научном сообществе микро- и нанороботы. Объем этого рынка в 2022 году преодолел отметку $6,96 млрд. Ожидается, что к 2032 году он достигнет отметки $32,19 млрд.
Нанороботы особенно эффективны для целевой доставки лекарств к клеткам-мишеням. Размер нанороботов варьируется от 1 до 100 нанометров (1 мм = 1 млн нм), а микророботов — от 100 нанометров до 100 микрометров (1 мкм = 1 тыс. нм).

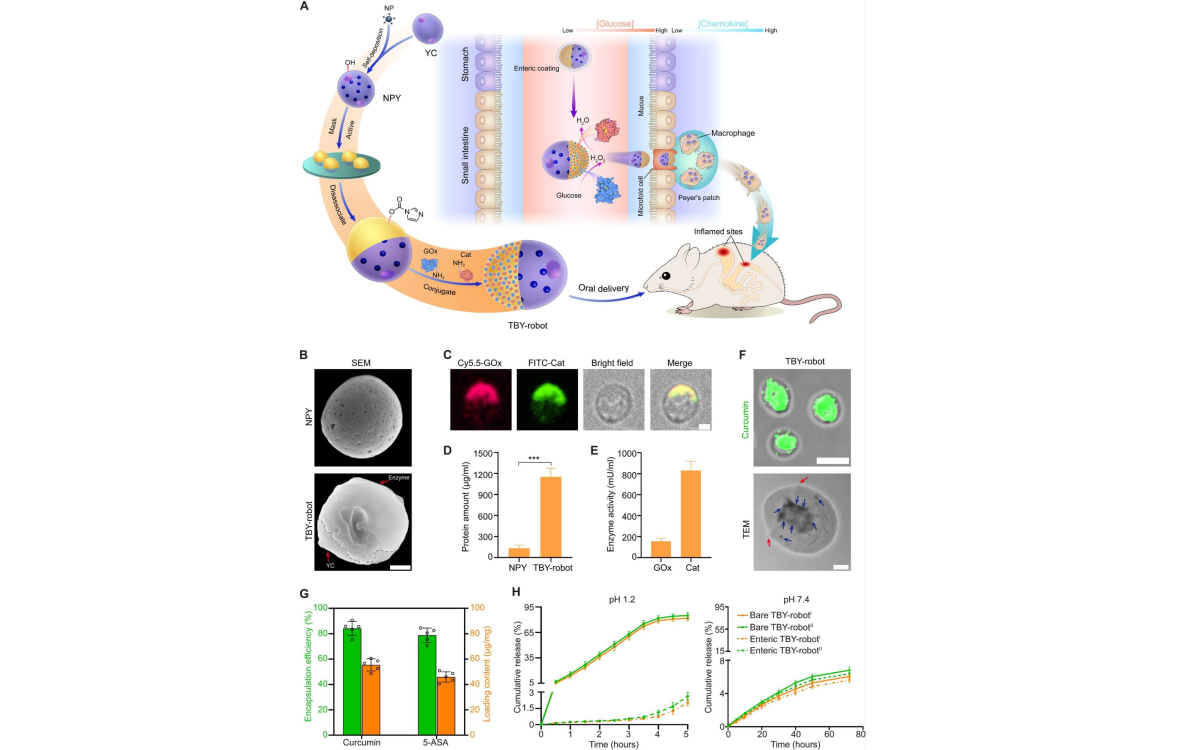
Невообразимо малые размеры устройств такого типа — их главное преимущество. Так, группа китайских исследователей под руководством профессора Хонг Пана создала биосовместимый наноробот на пекарских дрожжах для лечения ЖКТ. Ученые назвали разработку TBY-робот. Этот наноробот покрыт оболочкой от дрожжей Saccharomyces cerevisiae, а работает TBY на биохимическом двигателе — ферментах-макрофагах. Макрофаги могут проникать через биологические барьеры и нацеливаться на воспаленные участки, адресно доставляя препараты. Эксперимент на мышах показал хорошие результаты: улучшились биохимические показатели крови у мышей, объем накопленного лекарства увеличился в пораженном участке примерно в тысячу раз, в результате чего такие воспаления, как колит и язва желудка, значительно ослабли.
Испанские ученые применили наноробота для доставки противораковой терапии в клетки-мишени. Группа биохимиков из Института биоинженерии Каталонии создала микросферы с искусственным радиоактивным изотопом — йодом-131. Такую форму йода применяют в лечении онкологических болезней. Наноробот доставлял йод‑131 напрямую в раковые клетки. Это позволило более точечно и равномерно распределить препарат по злокачественным тканям. «С помощью одной дозы наночастиц мы добились 90-процентного сокращения объема опухолей у грызунов», — отметил руководитель исследования доктор Самуэль Санчес. Диаметр такого робота составлял всего 450 нм.
8. NGS-секвенирование
Секвенирование следующего поколения (NGS) — важнейший инструмент современной генетики. NGS включает группу методов, с помощью которых генетики изучают последовательности нуклеотидов ДНК и РНК. Методы отличаются между собой по скорости, точности воспроизведения и цене.
NGS-секвенирование позволяет параллельно секвенировать (расшифровывать) миллионы сегментов ДНК, дает подробную информацию о структуре генома и активности определенных генов. Мировой рынок NGS в связи с быстрой коммерциализацией технологии ожидаемо растет. В 2022 году он оценивался в $8,26 млрд. К 2032 году он может достигнуть $48,01 млрд, а среднегодовой темп роста составит 19,24%.
В погоне за более дешевыми и точными технологиями компания Illumina в 2023 году вывела на рынок аппарат NovaSeq X. Команда разработчиков заявила, что устройство позволит расшифровывать геном человека за $200 (в России сейчас такая процедура стоит около ₽90 тыс.).

Рост спроса на генетические исследования обеспечивается не только за счет NGS-технологии, но и других подходов, таких как одноклеточная геномика и пространственная транскриптомика. Все эти методы опираются на секвенирование ДНК.
9. Цифровые татуировки
Электронная татуировка — носимая схема с встроенными датчиками, которая крепится на коже и дистанционно передает данные. Цифровые татуировки живут на коже от нескольких дней до нескольких недель.
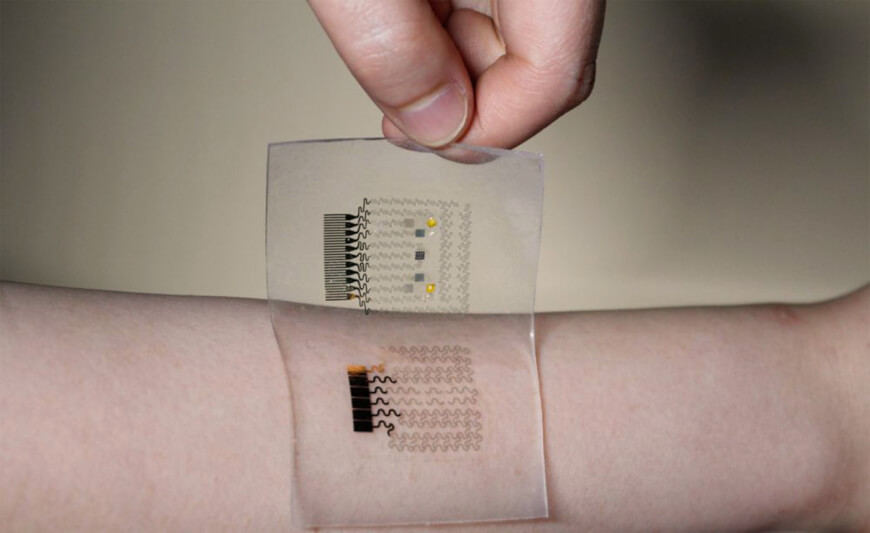
С помощью таких тату можно контролировать пульс, уровень глюкозы, температуру тела или проводить анализ химического состава крови, пота и слюны. Татуировки в медицине применяют не только в диагностике, но и в хирургии. Например, для маркировки областей кожи при радиотерапии.
В будущем такие приспособления могут позволить неинвазивно отслеживать общее состояние пациента: сердечную аритмию, нарушения мозговой деятельности. Особенно это важно для наблюдения за недоношенными детьми. Если смотреть еще дальше, то высокотехнологичные электронные татуировки смогут отслеживать сигналы мозга с точностью, достаточной для управления компьютером.
10. Нейропротезирование и нейрокомпьютерный интерфейс
Нейропротезирование занимается имплантацией искусственных устройств для восстановления функций нервной системы или органов чувств. Самый востребованный нейроимплант на сегодня — слуховой. Ожидается, что к 2050 году почти 2,5 млрд человек будут иметь проблемы со слухом, требующие такой аппарат. Согласно отчету, опубликованному компанией Facts & Factors, объем мирового рынка кохлеарных (слуховых) имплантов в 2022 году составил около $1,45 млрд.
Самый известный пример имплантируемых нейрокомпьютерных интерфейсов — это Telepathy, малоинвазивные чипы от Neuralink. В январе 2024 года нейрочип впервые имплантировали человеку. А в феврале глава компании Илон Маск сообщил, что участник эксперимента «может перемещать мышь по экрану, просто подумав об этом действии». Имплант, по заявлению его создателей, позволит управлять смартфоном и другими гаджетами силой мысли. В первую очередь он рассчитан на людей с ограниченными возможностями. При этом специалисты подчеркивают, что радикальным прорывом это назвать нельзя: нейрочипы тестируют на людях и животных с конца XX века.

Другой пример применения имплантов с ИИ в 2023 году показала группа американских ученых под руководством доктора Эдварда Чанга. Они внедрили женщине нейропротез, который преобразовывал мозговые сигналы в письменную и устную речь. Испытатели создали аватар и голос, которые воспроизводили всю информацию от импланта на планшете. Так устройство вернуло пациентке с параличом возможность общаться с окружающими людьми. Исследование опубликовано в журнале Nature.