
Сегодня врачи и пациенты используют носимые электронные устройства, чтобы отслеживать сердцебиение или уровень глюкозы в крови. При этом до сих пор нет устройства, которое корректировало бы работу организма на более фундаментальном — генетическом — уровне. Такой девайс может появиться в обозримом будущем. Научные сотрудники Цюрихской высшей технической школы и Базельского университета возлагают большие надежды на собственную разработку — технологию DART, использующую ток для включения модифицированного (целевого) гена в клетке. Технологию укомплектовали в переносимое устройство с питанием от батарейки АА и внедрили мышам, болеющим сахарным диабетом 1-го типа. Эксперимент показал, что с помощью DART-системы можно контролировать синтез инсулина в организме и восстанавливать нормальный уровень глюкозы в крови мышей за пять недель. По словам швейцарских ученых, это прорывное достижение молодой науки — электрогенетики.
Что такое электрогенетика
Электрогенетика — это новейшая область исследований на стыке инженерной генетики, синтетической биологии и электроники. Научные работы о редактировании генов с помощью тока начали появляться всего несколько лет назад. Направление настолько новое, что про электрогенетику еще нет статьи на Wikipedia, а в международной научной библиотеке Pubmed первая статья с упоминанием этой области исследований датирована 2021 годом.
С помощью электрогенетики ученые стремятся управлять работой генов. Они модифицируют ДНК растений, бактерий, животных и человека, используя электростимуляцию. Используя ток, электрогенетики контролируют экспрессию генов, то есть вмешиваются в процесс преобразования наследственной информации в функциональный продукт в организме — например, в белок.
Электрогенетика и клеточная терапия
В последнее время укрепляется интерес научного сообщества к дизайнерским клеткам — клеткам с измененным или расширенным функционалом. Эти клетки сконструированы так, чтобы воспринимать определенные физиологические сигналы, обрабатывать биохимическую информацию и реагировать запрограммированным образом. Их уже используют в противораковой терапии или для производства некоторых лекарств. Успешным примером использования дизайнерских клеток считается CAR-T-клеточная терапия. Это метод лечения лимфомы, лейкемии и множественной миеломы, основанный на использовании клеток крови пациента. T-лимфоциты извлекаются из крови больного, после чего их модифицируют так, чтобы они распознавали и атаковали опухолевые ткани. Затем отредактированные Т-клетки вводятся обратно в организм пациента. С 2017 года Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) одобрило шесть препаратов CAR-T-клеток для пациентов с раком крови на поздних стадиях. Хотя CAR-T-клеточная терапия пока не одобрена для общего применения, исследователи с оптимизмом смотрят на лечение с ее помощью разных видов рака, в том числе агрессивных форм. В перспективе клеточная терапия могла бы избавить пациентов от необходимости принимать лекарства или от хирургических вмешательств.
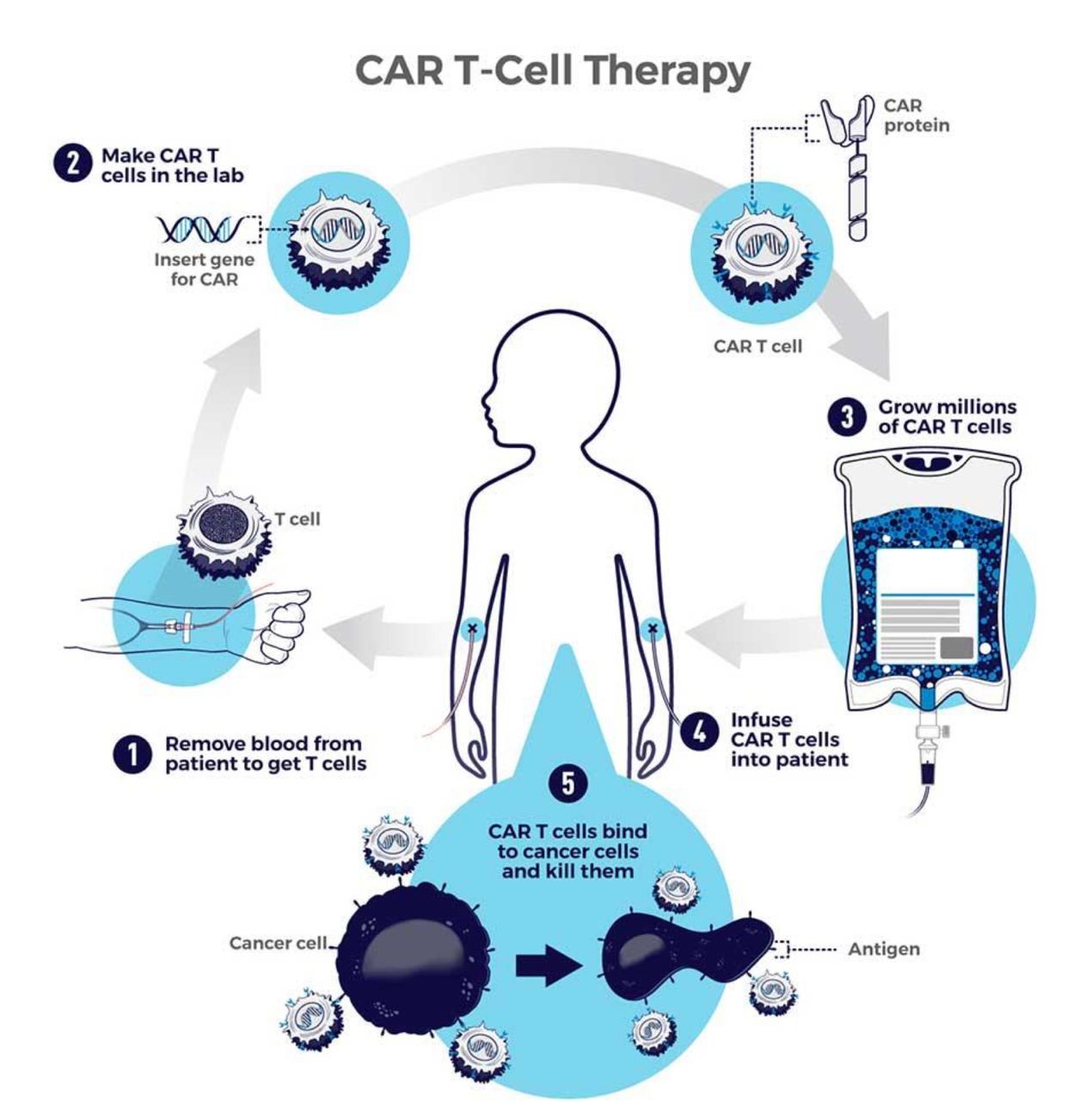
В недалеком будущем электрогенетика как часть синтетической биологии и генной инженерии может применяться учеными в клеточной терапии. Исследователи считают, что взаимодействие дизайнерских клеток с электронными устройствами позволит в будущем лучше и точнее контролировать такую терапию.
Электростимуляцию уже задействуют в программировании генов в дизайнерских, т.е. генетически измененных, клетках. Это пока делается для исследовательских целей, и электростимуляция клеток не используется в терапии и производстве лекарств. Но, как надеются ученые, в скором времени инструменты электрогенетики внедрятся в клеточную терапию и клиническую практику.
Клеточная терапия использует дизайнерские клетки (или клетки-конструкторы), способные воспринимать заданный входной сигнал, обрабатывать его в соответствии с разработанным учеными планом и производить заданный исследователями терапевтический результат. Такой алгоритм, состоящий из переменных «воспринять — обработать — произвести», применяется генетиками для улучшения естественной функции клетки или введения в нее новой функции.
Входной сигнал, или стимул, для терапевтической клетки может быть как химическим, так и физическим. К химическим относят биомаркеры заболеваний (например, высокий уровень глюкозы при диабете), стимулирующие пептиды (например, интерлейкины) и запахи (аромат мяты). Несмотря на то что химические стимуляторы широко используются в исследованиях по клеточной терапии, они имеют свои недостатки. Это, например, неадекватная фармакодинамика (неправильная реакция клетки на стимулятор) или широкое распределение химических веществ, что может привести к нежелательным побочным эффектам. В отличие от них физические триггеры — свет, температура, механические волны и магнитные поля, как считают ученые, предлагают более эффективный и безопасный подход, который позволяет создавать терапевтические дизайнерские клетки с высокой точностью.
Но хотя физические стимулы, такие как тепло и свет, применяют для программирования клеток-конструкторов, их использование тоже связано с рядом проблем. Так, их применение может сопровождаться цитотоксичностью (токсичным воздействием на клетку), неравномерным распределением сигнала и другими нежелательными эффектами.
Электрогенетика использует ток для управления функциями клеток-конструкторов. В отличие от других физических сигналов, электростимуляцию клеток можно производить с помощью относительно простых и доступных устройств (например, смартфонов, электронных часов или устройств с батарейкой). Это выгодно выделяет ток среди других физических стимуляторов для производства терапевтических клеток.
Тем не менее пока электрогенетика только зарождается как перспективное направление. Как считает генетик и биолог лаборатории Cerbalab Василиса Дудурич, электрогенетика в ближайшее время не будет востребована в медицине и других прикладных сферах, и ею будут заниматься только в рамках науки. «Пока у нас не внедрят в медицину методы секвенирования, метагеномику и транскриптомику (это займет около 10 лет), рано говорить о методах, влияющих на экспрессию генов», — подчеркивает эксперт.
DART-система: прорывная технология клеточной терапии
Сотрудники базельской Высшей технической школы Цюриха (ETH Zurich) во главе с профессором Мартином Фуссенеггером использовали ток как входной сигнал для контроля экспрессии генов в дизайнерских клетках. В статье «Электрогенетический интерфейс для программирования экспрессии генов млекопитающих», опубликованной в Nature Metabolism, ученые из ETH Zurich заявили, что нашли недостающее звено между химическим и электрическим уровнями внутриклеточного взаимодействия. Разработку они назвали технологией регулирования постоянным током (direct current (DC) actuated regulation technology) или DART.
«Электрогенетические интерфейсы, позволяющие электронным устройствам управлять экспрессией генов, остаются недостающим звеном на пути к полной совместимости и взаимодополняемости электронного и генетического миров», — говорится в исследовании.
Чтобы проверить эффективность своей технологии, команда Фуссенеггера внедрила дизайнерские клетки поджелудочной железы человека в организм мышей, больных сахарным диабетом 1-го типа. Именно бета-клетки поджелудочной железы отвечают за нормализацию сахара в крови. Затем модифицированные бета-клетки (их назвали клетками Electroβ) стимулировали постоянным током разной силы и продолжительности. В результате ученые пришли к выводу, что синтез инсулина (а в результате и уровень глюкозы в крови) был связан с силой и временем включения «генно-электрического интерфейса» DART. Устройство, состоящее из датчика глюкозы, ГМ-клеток, акупунктурных игл и нескольких батареек АА, включало гены, ответственные за выработку инсулина, и понижало уровень глюкозы в крови мыши до нормальных показателей.
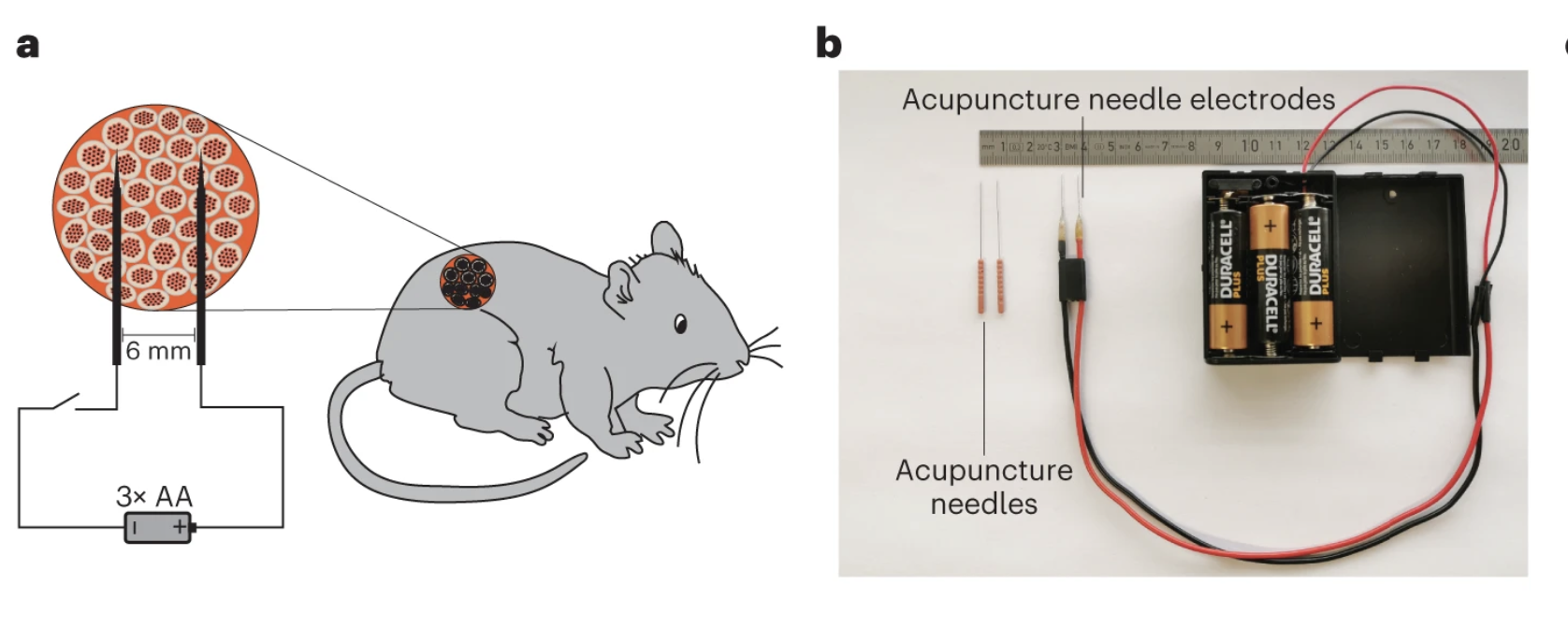
Как считают создатели DART-системы, в будущем устройства на ее основе можно будет использовать для диагностики и терапии хронических заболеваний, таких как остеопороз, хроническая обструктивная болезнь легких и психические расстройства.
Трудности использования тока в клеточной терапии
Использование дизайнерских клеток, работающих на токе, должно, по мнению авторов исследования, произвести революцию в терапии. Ведь, как заявляет группа швейцарских исследователей, разработка DART сочетает в себе минимальную цитотоксичность и высокую эффективность.
При этом ученые видят некоторые сложности в использовании электрочувствительных дизайнерских клеток в терапии человека.
Прежде всего, электрочипы для стимуляции дизайнерских клеток все еще слишком большие — это увеличивает вероятность побочных эффектов от постоянного использования такого девайса. «Существует острая необходимость в миниатюрных биосовместимых электронных устройствах, которые могли бы легко работать в организме с минимальными побочными эффектами», — говорится в исследовании. Кроме того, сейчас на электрочипах можно разместить небольшое количество клеток. И хотя для лечения мышей с диабетом 1-го типа было достаточно малой концентрации модифицированных клеток поджелудочной, для достижения такого же терапевтического эффекта у человека потребуется гораздо больше трансплантируемых клеток. Поэтому необходимы дальнейшие эксперименты по увеличению количества трансплантируемых клеток, пишут авторы исследования.
Хорошим примером носимых электронных устройств считается искусственная поджелудочная железа, которая может определять уровень глюкозы в крови и автоматически вводить в организм нужное количество инсулина с помощью встроенной инсулиновой помпы. По аналогии с таким бионическим протезом биоэлектроника нового поколения сможет определять биомаркеры заболевания с помощью электронного устройства и стимулировать дизайнерские клетки к выработке нужного лекарства. К тому же такая система сможет отправлять необходимые данные по состоянию здоровья пациента через интернет, например, врачу.
Что касается потенциального риска хакерских атак и утечки личных данных пациентов, то ученые предполагают, что смогут обеспечить носителям своих девайсов необходимую защиту. «Люди уже носят кардиостимуляторы, которые теоретически уязвимы для кибератак, но эти устройства имеют достаточную защиту. Мы же должны предусмотреть такую защиту и в наших имплантатах», — говорит Фуссенеггер.
Что предшествовало электрогенетике: бактерии, контактирующие с помощью электрических сигналов
Электрические сигналы играют важную роль в передаче информации и координации разных функций организма. Нервные импульсы, сердечные ритмы, мышечные сокращения — все эти процессы работают благодаря электрическим сигналам, передающимся по клеточным мембранам и нервным волокнам.
Примеры электрохимического взаимодействия встречается и в природе. Так, электрохимически активные бактерии «общаются» друг с другом через электрические импульсы, подобные тем, которые проходят в нейронных сетях высших животных. Кроме того, было показано, что экспрессия различных генов в электрохимически активной бактерии — кишечной палочке (Escherichia coli) — регулируется с помощью тока. Исследования по генетической регуляции таких бактерий и легли в основу электрогенетики.
Перспективы: где будет применяться электрогенетика
Возможности новой науки расширяются с развитием биоэлектрических приспособлений, которые содержат живые отредактированные клетки. Электростимуляция может использоваться для создания биологических компьютеров, бионических протезов, биосенсоров.
Дальнейшие исследования в области электрогенетики могут привести к разработке улучшенных методов ведения сельского хозяйства, повышению урожайности. Так, легкая электростимуляция может ускорить развитие корней, улучшать поглощение питательных веществ и повышать общую жизнеспособность растений. Это имеет большое значение для улучшения приживаемости и раннего роста культур, особенно в неблагоприятных условиях.




